از طریق منوی جستجو مطلب مورد نظر خود در وبلاگ را به سرعت پیدا کنید
مدل AI کد موجود در پروتئین ها را رمزگشایی می کند که به آنها می گوید کجا بروند
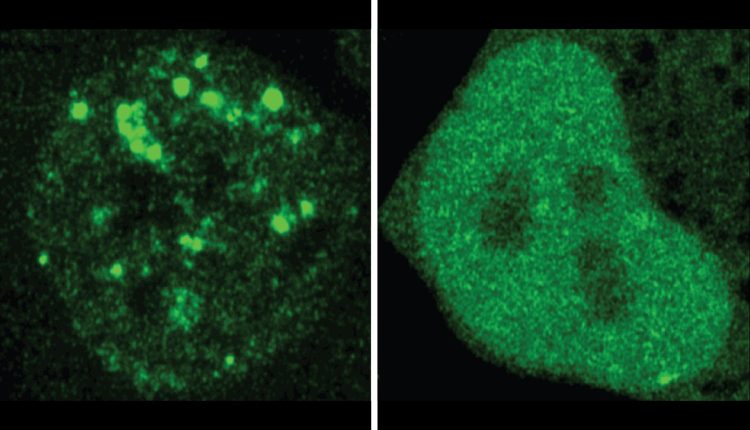
پروتئین ها کارگرانی هستند که سلول های ما را در حال اجرا نگه می دارند و هزاران نوع پروتئین در سلولهای ما وجود دارد که هر یک عملکرد تخصصی دارند. محققان مدتهاست که می دانند که ساختار یک پروتئین تعیین می کند که چه کاری می تواند انجام دهد. اخیراً ، محققان می توانند درک کنند که بومی سازی پروتئین نیز برای عملکرد آن بسیار مهم است. سلولها پر از محفظه هایی هستند که به سازماندهی بسیاری از آنها کمک می کنند. این فضاها همراه با اندامک های مشهور که صفحات کتابهای درسی زیست شناسی را آراسته می کنند ، انواع مختلفی از محفظه های پویا و کمتر غشایی را نیز شامل می شوند که مولکولهای خاصی را در کنار هم متمرکز می کنند تا عملکردهای مشترک را انجام دهند. بنابراین با دانستن اینکه یک پروتئین داده شده در کجا بومی سازی می شود ، و با چه کسی محلی می شود ، بنابراین می تواند برای درک بهتر پروتئین و نقش آن در سلول سالم یا بیمار مفید باشد ، اما محققان فاقد یک روش منظم برای پیش بینی این اطلاعات هستند.
در همین حال ، ساختار پروتئینی برای بیش از نیم قرن مورد مطالعه قرار گرفته است ، که در ابزار هوش مصنوعی Alphafold به اوج خود رسیده است ، که می تواند ساختار پروتئین را از کد اسید آمینه پروتئین ، رشته خطی بلوک های ساختمان در آن پیش بینی کند که برای ایجاد ساختار آن برابر است. Alphafold و مدل هایی مانند آن به ابزارهای گسترده ای در تحقیق تبدیل شده اند.
پروتئین ها همچنین حاوی مناطقی از اسیدهای آمینه هستند که در یک ساختار ثابت قرار نمی گیرند ، اما در عوض برای کمک به پروتئین ها در پیوستن به محفظه های پویا در سلول مهم هستند. پروفسور MIT ریچارد یانگ و همکارانش از این سؤال پرسیدند که آیا می توان از کد موجود در آن مناطق برای پیش بینی بومی سازی پروتئین به همان روشی که مناطق دیگر برای پیش بینی ساختار استفاده می شود ، استفاده کرد. محققان دیگر برخی از توالی های پروتئینی را کشف کرده اند که برای بومی سازی پروتئین کد می کنند ، و برخی از آنها توسعه مدل های پیش بینی کننده برای محلی سازی پروتئین را آغاز کرده اند. با این حال ، محققان نمی دانند که آیا محلی سازی پروتئین به هر محفظه پویا می تواند مبتنی بر پیش بینی شود روی دنباله آن ، و همچنین ابزاری قابل مقایسه با Alphafold برای پیش بینی بومی سازی نداشتند.
اکنون ، جوان ، همچنین عضو موسسه تحقیقات بیولوژیکی وایتهد. HENRY KILGORE ، آزمایشگاه جوان آزمایشگاه جوان ؛ Regina Barzilay ، دانشکده مهندسی استاد برجسته برای هوش مصنوعی و بهداشت در آزمایشگاه علوم کامپیوتر و هوش مصنوعی MIT (CSAIL) ؛ و همکاران چنین مدلی را ساخته اند که آنها را پروتز می نامند. در مقاله منتشر شده روی 6 فوریه در مجله علمبا نویسندگان اول Kilgore و دانشجویان فارغ التحصیل آزمایشگاه بارزیلای Itamar Chinn ، Peter Mikhael و Ilan Mitnikov ، تیم بین رشته ای الگوی خود را آغاز می کند. محققان نشان می دهند که ProtGPS می تواند پیش بینی کند که کدام یک از 12 نوع شناخته شده از محفظه پروتئین بومی سازی می کند ، و همچنین آیا جهش مرتبط با بیماری باعث تغییر محلی سازی می شود. علاوه بر این ، تیم تحقیقاتی یک الگوریتم تولیدی ایجاد کرده است که می تواند پروتئین های جدید را برای بومی سازی در محفظه های خاص طراحی کند.
یانگ می گوید: “امید من این است که این اولین گام به سوی یک بستر قدرتمند است که به افرادی که پروتئین ها را مطالعه می کنند ، می توانند تحقیقات خود را انجام دهند. فرآیندهای طبیعی و روش تولید فرضیه های درمانی و طراحی داروها برای درمان اختلال عملکرد در یک سلول. “
محققان همچنین بسیاری از پیش بینی های مدل را با آزمایش های تجربی در سلول ها تأیید کردند.
بارزیلای می گوید: “این واقعاً من را هیجان زده کردم که بتوانم از طراحی محاسباتی تمام راه را برای امتحان کردن این چیزها در آزمایشگاه بروم.” وی گفت: “مقالات هیجان انگیز زیادی در این زمینه از هوش مصنوعی وجود دارد ، اما 99.9 درصد از این افراد هرگز در سیستم های واقعی آزمایش نمی شوند. با تشکر از همکاری ما با آزمایشگاه جوان ، ما توانستیم آزمایش کنیم و واقعاً یاد گرفتیم که الگوریتم ما چقدر خوب است. “
توسعه مدل
محققان پروتزهای آموزش و آزمایش را آزمایش و آزمایش کردند روی دو دسته پروتئین با محلی سازی شناخته شده. آنها دریافتند که می تواند به درستی پیش بینی کند که پروتئین ها با دقت بالا به کجا می رسند. محققان همچنین آزمایش کردند که چگونه Protgps می تواند تغییرات در محلی سازی پروتئین را پیش بینی کند روی جهش های مرتبط با بیماری در یک پروتئین. بسیاری از جهش ها – تغییر در توالی برای یک ژن و پروتئین مربوطه – یافت شده است که باعث ایجاد یا ایجاد بیماری می شود روی مطالعات انجمن ، اما روش هایی که جهش ها منجر به علائم بیماری می شوند ناشناخته هستند.
تشخیص مکانیسم چگونگی کمک به یک جهش به بیماری مهم است زیرا محققان می توانند برای رفع این مکانیسم ، جلوگیری یا درمان بیماری ، روشهای درمانی را ایجاد کنند. جوان و همکاران گمان کردند که بسیاری از جهشهای مرتبط با بیماری با تغییر بومی سازی پروتئین به بیماری کمک می کنند. به عنوان مثال ، یک جهش می تواند پروتئین نتواند به یک محفظه حاوی شرکای اساسی بپیوندد.
آنها این فرضیه را با تغذیه پروتئین بیش از 200،000 پروتئین با جهش های مرتبط با بیماری آزمایش کردند و سپس از آن درخواست کردند که هر دو پروتئین جهش یافته را محلی سازی کنند و اندازه گیری کنند که پیش بینی آن برای یک پروتئین خاص از نسخه طبیعی به نسخه جهش یافته تغییر می کند. تغییر بزرگ در پیش بینی نشانگر تغییر احتمالی در محلی سازی است.
محققان موارد بسیاری را پیدا کردند که در آن یک جهش مرتبط با بیماری به نظر می رسد محلی سازی پروتئین را تغییر می دهد. آنها 20 نمونه را در سلول ها آزمایش کردند و با استفاده از فلورسانس برای مقایسه اینکه در سلول یک پروتئین طبیعی و نسخه جهش یافته آن به پایان رسید. این آزمایشات پیش بینی های ProTGPS را تأیید کرد. در مجموع ، این یافته ها از این ظن محققان حمایت می کنند که محلی سازی نادرست ممکن است مکانیسم کم ارزش بیماری باشد و ارزش ProtGP ها را به عنوان ابزاری برای درک بیماری و شناسایی راه های درمانی جدید نشان می دهد.
میتنیکوف می گوید: “این سلول یک سیستم پیچیده است و دارای بسیاری از مؤلفه ها و شبکه های پیچیده تعامل است.” وی گفت: “بسیار جالب است که فکر کنیم با این رویکرد می توانیم سیستم را آشفته کنیم ، نتیجه آن را ببینیم ، و بنابراین کشف مکانیسم های موجود در سلول یا حتی توسعه درمانی مبتنی بر آن روی که. “
محققان امیدوارند که دیگران با استفاده از مدل های ساختاری پیش بینی مانند Alphafold ، استفاده از Protgps را شروع کنند و پروژه های مختلفی را پیش می برند روی عملکرد پروتئین ، اختلال عملکرد و بیماری.
فراتر از پیش بینی به نسل جدید
محققان از استفاده احتمالی مدل پیش بینی خود هیجان زده بودند ، اما آنها همچنین می خواستند که مدل آنها فراتر از پیش بینی محلی سازی پروتئین های موجود باشد و به آنها اجازه می دهد پروتئین های کاملاً جدید را طراحی کنند. هدف این بود که این مدل توالی اسید آمینه کاملاً جدیدی را تشکیل دهد که وقتی در یک سلول تشکیل می شود ، به یک مکان مورد نظر بومی سازی می شود. تولید یک پروتئین جدید که در واقع می تواند یک عملکرد را انجام دهد – در این حالت ، عملکرد بومی سازی به یک محفظه سلولی خاص – بسیار دشوار است. محققان به منظور بهبود شانس موفقیت مدل خود ، الگوریتم خود را محدود کردند تا فقط پروتئین هایی مانند آنچه در طبیعت یافت می شود ، طراحی کنند. این رویکردی است که به دلایل منطقی معمولاً در طراحی مواد مخدر استفاده می شود. طبیعت میلیاردها سال داشته است تا بفهمد که توالی پروتئین به خوبی کار می کند و کدام یک نیست.
به دلیل همکاری با آزمایشگاه جوان ، تیم یادگیری ماشینی توانست آزمایش کند که آیا تولید کننده پروتئین آنها کار می کند یا خیر. این مدل نتایج خوبی داشت. در یک دور ، 10 پروتئین در نظر گرفته شده برای بومی سازی در هسته ایجاد شده است. هنگامی که محققان این پروتئین ها را در سلول آزمایش کردند ، دریافتند که چهار مورد از آنها به شدت در هسته قرار می گیرند ، و برخی دیگر ممکن است تعصب کمی نسبت به آن مکان داشته باشند.
میکایل می گوید: “همکاری بین آزمایشگاه های ما برای همه ما بسیار مولد بوده است.” وی گفت: “ما آموخته ایم که چگونه به زبان های یکدیگر صحبت کنیم ، در مورد ما چیزهای زیادی در مورد روش کار سلول ها آموخته است ، و با داشتن فرصتی برای آزمایش آزمایشی مدل خود ، ما توانسته ایم بفهمیم که برای انجام واقعاً چه کاری باید انجام دهیم مدل کار می کند ، و سپس آن را بهتر می کند. “
قادر به تولید پروتئین های عملکردی از این طریق می تواند توانایی محققان در توسعه روشهای درمانی را بهبود بخشد. به عنوان مثال ، اگر یک دارو باید با هدفی که در یک محفظه خاص بومی سازی می شود ، تعامل داشته باشد ، محققان می توانند از این مدل برای طراحی یک دارو برای بومی سازی در آنجا استفاده کنند. این امر باید دارو را مؤثرتر کند و عوارض جانبی را کاهش دهد ، زیرا این دارو زمان بیشتری را در تعامل با هدف خود و زمان کمتری در تعامل با سایر مولکول ها صرف می کند و باعث اثرات خارج از هدف می شود.
اعضای تیم یادگیری ماشین از چشم انداز استفاده از آنچه از این همکاری آموخته اند برای طراحی پروتئین های جدید با سایر کارکردهای فراتر از بومی سازی ، علاقه مند هستند ، که این امر امکان طراحی درمانی و سایر برنامه ها را گسترش می دهد.
چینی می گوید: “بسیاری از مقالات نشان می دهند که می توانند پروتئین را طراحی کنند که می تواند در یک سلول بیان شود ، اما این پروتئین عملکرد خاصی دارد.” ما در واقع طراحی پروتئین عملکردی و میزان موفقیت نسبتاً عظیمی در مقایسه با سایر مدلهای تولیدی داشتیم. این برای ما واقعاً هیجان انگیز است ، و چیزی که دوست داریم بسازیم روی. “
همه محققان درگیر ، Protgps را یک آغاز هیجان انگیز می دانند. آنها پیش بینی می کنند که از ابزار آنها برای کسب اطلاعات بیشتر در مورد نقش بومی سازی در عملکرد پروتئین و محلی سازی نادرست در بیماری استفاده شود. علاوه بر این ، آنها علاقه مند به گسترش پیش بینی های محلی سازی مدل هستند تا انواع بیشتری از محفظه ها ، آزمایش فرضیه های درمانی بیشتر و طراحی پروتئین های به طور فزاینده ای برای روشهای درمانی یا سایر برنامه ها را شامل شود.
کیلگور می گوید: “اکنون که می دانیم این کد پروتئین برای بومی سازی وجود دارد ، و مدل های یادگیری ماشین می توانند آن کد را حس کنند و حتی پروتئین های عملکردی را با استفاده از منطق آن ایجاد کنند ، که باعث می شود در بسیاری از مطالعات و کاربردهای بالقوه باز شود.”
منبع: https://news.mit.edu/1404/ai-model-deciphers-code-proteins-tells-them-where-to-go-0213
لطفا در صورت وجود مشکل در متن یا مفهوم نبودن توضیحات، از طریق دکمه گزارش نوشتار یا درج نظر روی این مطلب ما را از جزییات مشکل مشاهده شده مطلع کنید تا به آن رسیدگی کنیم
زمان انتشار: 1404-02-14 07:41:11



